Flawonoid procyjanidyna C1 ma działanie senoterapeutyczne i wydłuża życie myszy
Abstrakcyjny
Pogorszenie czynności narządów związane ze starzeniem się i zwiększone ryzyko przewlekłych patologii związanych z wiekiem są częściowo napędzane przez akumulację starzejących się komórek, które rozwijają fenotyp wydzielniczy związany ze starzeniem (SASP). Tutaj pokazujemy, że procyjanidyna C1 (PCC1), polifenolowy składnik ekstraktu z pestek winogron (GSE), zwiększa zdrowie i żywotność myszy poprzez działanie na starzejące się komórki. Przeprowadzając badania przesiewowe biblioteki produktów naturalnych, stwierdzamy, że GSE i PCC1 jako jeden z jego aktywnych składników mają specyficzny wpływ na starzejące się komórki. W niskich stężeniach PCC1 wydaje się hamować tworzenie SASP, podczas gdy w wyższych stężeniach selektywnie zabija starzejące się komórki, prawdopodobnie poprzez promowanie wytwarzania reaktywnych form tlenu i dysfunkcji mitochondriów. W modelach dla gryzoni PCC1 zuboża starzejące się komórki w mikrośrodowisku nowotworowym uszkodzonym przez leczenie i zwiększa skuteczność terapeutyczną przy jednoczesnym podawaniu z chemioterapią. Przerywane podawanie PCC1 myszom napromieniowanym, starzejącym się z wszczepionymi komórkami lub naturalnie starzejącym się starym myszom łagodzi dysfunkcję fizyczną i przedłuża przeżycie. PCC1 identyfikujemy jako naturalny środek senoterapeutyczny o aktywności in vivo i wysokim potencjale dalszego rozwoju jako interwencja kliniczna mająca na celu opóźnienie, złagodzenie lub zapobieganie patologiom związanym z wiekiem.
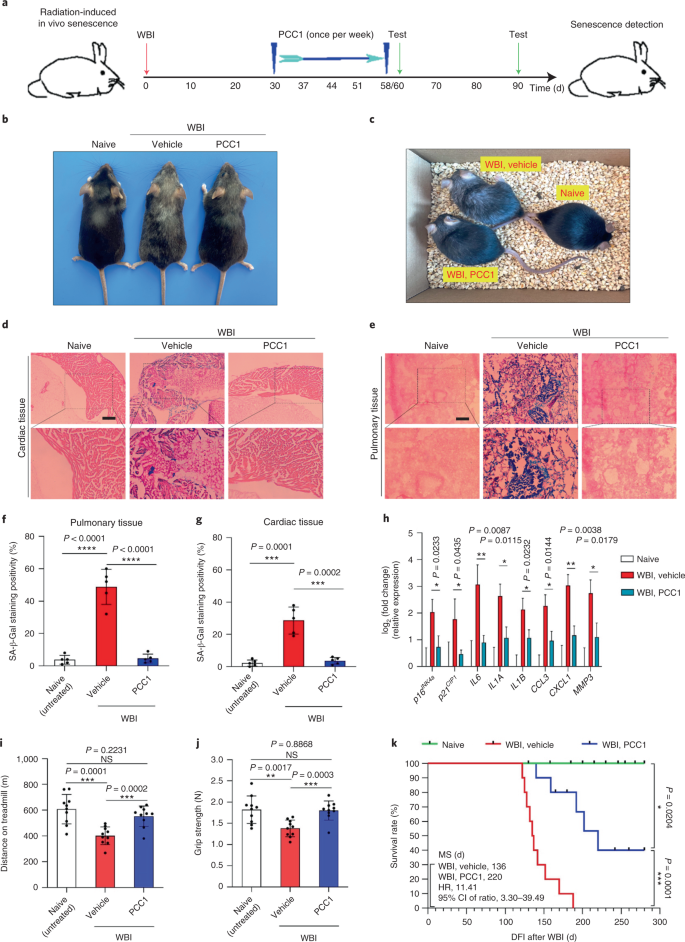
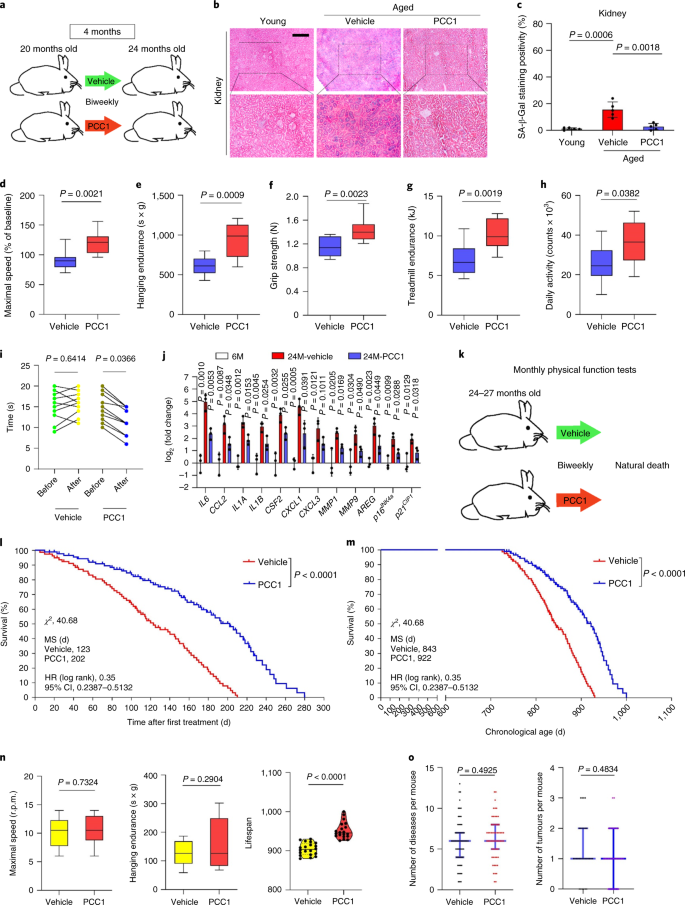
Starzenie się jest jednym z największych czynników ryzyka chorób przewlekłych, w tym chorób sercowo-naczyniowych, zaburzeń metabolicznych, patologii neurodegeneracyjnych i różnych nowotworów złośliwych, które razem odpowiadają za większość zachorowalności, śmiertelności i kosztów zdrowotnych na całym świecie1. W ostatnich latach poczyniono znaczne postępy w opracowywaniu specyficznych środków do leczenia poszczególnych schorzeń związanych z wiekiem, takich jak cukrzyca typu 2, osteoporoza, kruchość szkieletu i dysfunkcja naczyń. Jednak łączny wpływ tych leków na kontrolowanie zachorowalności i umieralności w przypadku chorób przewlekłych był niewielki, a choroby te mają tendencję do występowania synchronicznie jako choroby wielochorobowe, przy czym częstość występowania wzrasta wykładniczo po 70 roku życia2. Kilka głównych czynników wpływających na długość zdrowia i długość życia zostało zidentyfikowanych w badaniach na wielu gatunkach i zdefiniowanych jako mechanizmy starzenia, które można podzielić na dziewięć cech charakterystycznych3. Spośród tych podstawowych mechanizmów starzenia szczególną uwagę poświęcono starzeniu się komórek, ponieważ jest to proces, który można zastosować do leków, który zapobiega wielu współistniejącym schorzeniom związanym ze starzeniem się lub je opóźnia.4. Po raz pierwszy opisana w latach sześćdziesiątych, starzenie się komórek odnosi się do stanu komórkowego obejmującego zasadniczo nieodwracalne zatrzymanie replikacji, głębokie zmiany chromatyny, odporność na apoptozę i zwiększoną syntezę białek, często kończącą się nadprodukcją prozapalnych cytokin, cechą określaną jako SASP, która uważana jest za napędzać fenotypy starzenia i różne patologie związane z wiekiem5. Ablacja starzejących się komórek pozytywnych dla markera starzenia p16INK4A łagodzi degenerację tkanek i wydłuża żywotność zwierząt, potwierdzając tezę, że starzejące się komórki odgrywają sprawczą rolę w starzeniu się organizmu6,7. Sukces w badaniach przedklinicznych zainspirował do rozpoczęcia badań klinicznych sprawdzających słuszność koncepcji z udziałem leków senolitycznych w przypadku kilku chorób u ludzi, które mogą zmniejszyć obciążenie starzejących się komórek in vivo poprzez selektywną eliminację farmakologiczną8,9,10. Od pierwszego odkrycia w 2015 roku (ref. 11), znana jest obecnie garść syntetycznych lub małocząsteczkowych środków senolitycznych. Strategie celowania opierają się głównie na mechanizmie odporności starzejących się komórek na apoptozę, który wydaje się zależeć od związanych ze starzeniem się szlaków antyapoptotycznych, które umożliwiają przeżycie starzejących się komórek przez dłuższy czas12,13. Sporadyczne podawanie senolityków może zmniejszyć ryzyko wystąpienia u pacjentów niekorzystnych warunków, zminimalizować pozacelowe działanie leków i zapobiec rozwojowi lekooporności starzejących się komórek, które nie dzielą się, co odróżnia je od komórek nowotworowych, ponieważ komórki rakowe często nabywają korzystne mutacje zapewniające odporność na terapie przeciwnowotworowe. Jednak większość opisywanych senolityków zależy od linii komórkowej lub typu komórki lub, alternatywnie, wykazuje znaczną cytotoksyczność in vivo, co ogranicza ich potencjalne zastosowanie do celów klinicznych. W tym badaniu przeszukaliśmy bibliotekę medyczną produktów naturalnych złożoną ze środków przeciwstarzeniowych i zidentyfikowaliśmy kilku kandydatów, w tym GSE. Dalsza analiza wykazała, że PCC1, składnik epikatechiny typu B, będący składnikiem flawonoidów GSE, odgrywa główną rolę w hamowaniu ekspresji SASP w niskich stężeniach i zabijaniu starzejących się komórek w wyższych stężeniach, w tym ostatnim poprzez indukowanie apoptozy. Dane przedkliniczne sugerowały, że w połączeniu z klasyczną chemioterapią PCC1 może znacząco zmniejszyć wielkość guza i przedłużyć przeżycie w kilku modelach mysich. Tak więc PCC1 reprezentuje nową klasę fitochemicznych senolityków izolowanych z naturalnych źródeł, które opóźniają starzenie się i łagodzą zaburzenia związane z wiekiem oraz uzasadniają dalsze badania jako potencjalny czynnik geroprotekcyjny w medycynie klinicznej. W celu zidentyfikowania nowych związków, które mogą skutecznie modulować starzejące się komórki, przeprowadzono obiektywne badanie przesiewowe agentów z wykorzystaniem biblioteki fitochemicznej złożonej z 46 środków leczniczych pochodzenia roślinnego (biblioteka PDMA). W tym celu zastosowaliśmy podstawową normalną ludzką linię komórek zrębu prostaty, PSC27, jako model oparty na komórkach. Składa się głównie z fibroblastów, ale z niewielkim odsetkiem linii komórkowych innych niż fibroblasty, w tym komórek śródbłonka i komórek mięśni gładkich, PSC27 jest podstawową linią komórkową per se i rozwija typowy SASP po ekspozycji na stresory, takie jak chemioterapia genotoksyczna lub promieniowanie jonizujące14,15,16,17. Traktowaliśmy te komórki wstępnie zoptymalizowaną subletalną dawką bleomycyny (50 μg ml-1) i zaobserwowano zwiększone barwienie β-galaktozydazą związaną ze starzeniem się (SA-β-Gal), zmniejszone włączanie 5-bromodeoksyurydyny i zwiększone ogniska naprawy uszkodzeń DNA (DDR) 7–10 dni po (ryc. uzupełniający 1a – c). Opracowaliśmy strategię badań przesiewowych, aby porównać wpływ poszczególnych produktów leczniczych na przeżycie i profil ekspresji starzejących się komórek (rys. danych rozszerzonych 1a). Obiecującą zaletą środków senolitycznych jest selektywne wywoływanie programowanej śmierci starzejących się komórek, takich jak ABT-263, ABT-737 oraz łączne stosowanie dazatynibu i kwercetyny11,18,19. Najpierw przetestowaliśmy skuteczność tych leków geroprotekcyjnych wobec starzejących się komórek PSC27, aby zademonstrować ich potencjał jako eksperymentalnego modelu komórkowego do badań przesiewowych leków. Nasze wstępne dane sugerowały, że każdy z tych związków znacząco zubożał komórki starzejące się, ale nie komórki proliferujące, potwierdzając w ten sposób możliwość wykorzystania tej linii zrębu do dalszych badań (Dane rozszerzone Ryc. 1b). Po przeszukaniu biblioteki PDMA na dużą skalę zidentyfikowaliśmy kilka związków, które mogą selektywnie zabijać starzejące się komórki w hodowli (Extended Data Fig. 1c-e). Wśród środków wykazujących wstępne działanie przeciwstarzeniowe były GSE, kwercetyna, fisetyna, kurkumina i piperlongumina (Dane rozszerzone Ryc. 1d, e). Kwercetyna i fisetyna mają podobną budowę chemiczną, wywierają podobne działanie lecznicze i są znanymi lekami senolitycznymi11,20,21. Kurkumina i piperlongumina to także naturalne związki o niedawno odkrytym potencjale senolitycznym22,23. Zdecydowaliśmy się skoncentrować na GSE, które pozostało w dużej mierze niedostatecznie zbadanym źródłem. W warunkach in vitro GSE tłumił SASP z maksymalną wydajnością przy 0,1875 μg ml-1 (Dane rozszerzone rys. 2a), co pasuje do właściwości senomorfika24. Niższe lub wyższe stężenia GSE były mniej skuteczne, być może ze względu na indukcję odpowiedzi na stres komórkowy w wyniku zwiększonej cytotoksyczności (rys. danych rozszerzonych 2a). Stosując sekwencje RNA odkryliśmy, że leczenie GSE znacząco zmieniło profil ekspresji komórek starzejących się, z 2644 genami regulowanymi w dół i 1472 genami regulowanymi w górę przy krotności zmiany 2,0 na gen (P < 0,01) (Dane rozszerzone rys. 2b). Chociaż ekspresja kilku genów niezwiązanych z SASP wykazywała podobną tendencję jak w przypadku typowych czynników SASP (Extended Data Ryc. 2c), dane z naszej analizy wzbogacenia zestawu genów (GSEA) potwierdziły zmniejszoną ekspresję sygnatur molekularnych SASP lub aktywację kompleksu czynnika jądrowego (NF)-κB, który jest kluczowym mediatorem fenotypu prozapalnego (rys. rozszerzonych danych 2d, e). Translokację jądrową p65, jednej z głównych podjednostek kompleksu NF-κB, zaobserwowano w starzejących się komórkach, zgodnie z jej funkcjonalnym zaangażowaniem w ekspresję SASP14 (Dane rozszerzone rys. 2f). Warto zauważyć, że tendencja ta była zasadniczo antagonizowana przez GSE w niskich stężeniach (takich jak 0,1875 μg ml-1). I odwrotnie, aktywacja sygnalizacji NF-κB nie była tłumiona, ale raczej wydawała się wzmocniona, gdy GSE był stosowany w wyższych stężeniach (takich jak 3,7500 μg ml-1), co sugeruje zróżnicowane odpowiedzi starzejących się komórek w tych warunkach leczenia. Aktywacja sygnalizacji DDR, o czym świadczy fosforylacja kinazy ATM we frakcjach jądrowych, oraz ekspresja motywu C–X–C ligandu chemokiny (CXCL)8, jednego z czynników charakterystycznych dla SASP, obserwowanej we frakcjach cytoplazmatycznych, były zgodne z NF -κB aktywacja w tych ustawieniach (Dane rozszerzone Rys. 2f). Profilowanie interakcji białko-białko ujawniło wysoce aktywną sieć obejmującą wiele czynników znacząco podwyższonych po starzeniu się komórek, ale regulowanych w dół, gdy komórki zostały wystawione na GSE (Extended Data Fig. 3a). Profilowanie ontologii genów ujawniło, że cząsteczki te są funkcjonalnie zaangażowane w procesy biologiczne i związane z komponentami komórkowymi, ogólnie zgodne z sekrecyjną naturą SASP (Extended Data Fig. 3b,c). Tak więc GSE jest produktem naturalnym, który może kontrolować profil prozapalny starzejących się komórek, SASP, gdy jest stosowany w określonym zakresie stężeń. Chociaż GSE nie był jedynym naturalnym produktem o skuteczności senolitycznej w naszych testach komórkowych (Dane rozszerzone Ryc. 1d, e), nasze późniejsze badanie w dużej mierze koncentrowało się na GSE, ponieważ jego zdolność geroochronna wydawała się szczególnie uderzająca. Biorąc pod uwagę skuteczność GSE w zmniejszaniu SASP jako środka senomorficznego, zbadaliśmy następnie potencjał tego naturalnego produktu w zabijaniu starzejących się komórek w wyższych stężeniach, działając jako środek senolityczny. Barwienie SA-β-Gal wykazało, że starzejące się komórki zostały wyeliminowane przy stężeniu GSE 0,75 μg ml-1 (Figa. 1a,b). Przy 3,75 μg ml-1 GSE, osiągnięto plateau 20% przeżywalności starzejących się komórek (ryc. 1a,b). a, Ocena ilościowa przeżycia starzejących się komórek PSC27 przez dodatni wynik SA-β-Gal. GSE zastosowano do pożywki w rosnących stężeniach. CTRL, komórki kontrolne (proliferujące); SEN, starzejące się komórki; NS, nieistotne. P wartości obliczono za pomocą jednokierunkowej analizy ANOVA z testem wielokrotnego porównania Tukeya. breprezentatywne obrazy przedstawiające barwienie SA-β-Gal po potraktowaniu komórek PSC27 różnymi stężeniami GSE. Skala, 20 μm. Dane są reprezentatywne dla trzech niezależnych eksperymentów. DMSO, dimetylosulfotlenek. C, Analiza przeżycia kontrolnych i starzejących się komórek PSC27 po traktowaniu GSE (w stężeniach 0,3750, 0,7500, 1,8750, 3,7500, 7,5000 i 15,0000 μg ml-1, odpowiednio). Dane są przedstawione jako średnia ± odchylenie standardowe i pochodzą z trzech powtórzeń biologicznych (n = 3 niezależne testy). P wartości obliczono metodą dwustronną T-testy. D, Pomiar przebiegu w czasie żywotności in vitro po potraktowaniu kontrolnych i starzejących się komórek PSC27 GSE (3,75 μg ml-1). Dane są przedstawione jako średnia ± odchylenie standardowe i pochodzą z trzech powtórzeń biologicznych (n = 3 niezależne eksperymenty). P wartości obliczono metodą dwustronną T-testy. i, Pomiar metodą cytometrii przepływowej kontrolnych i starzejących się komórek PSC27 po obróbce za pomocą zestawu aneksyny V-FITC i jodku propidyny (PI) oraz barwienia 4,6-diamidyno-2-fenyloindolem (DAPI) w celu określenia stopnia apoptozy. Q1–Q4, kwartyle 1-4. F, Porównawcza kwantyfikacja odsetka żywotnych (Q4, PI−aneksyna V−) i apoptotyczne (Q2 i Q3, PI+aneksyna V+ i PI−aneksyna V+, odpowiednio) komórki w kontrolnych lub starzejących się populacjach traktowanych nośnikiem lub GSE przez 3 dni (n = 3 biologicznie niezależne testy). P wartości obliczono metodą dwustronną T-testy. g, Pomiar sygnału fluorescencji MitoSOX Red, mitochondrialnego wskaźnika ponadtlenkowego, w komórkach PSC27 w różnych warunkach. P wartości obliczono metodą dwustronną T-testy. h, Widma masowe o wysokiej rozdzielczości pokazujące chromatogram całkowitych jonów (TIC) i chromatogram piku podstawowego GSE po przeprowadzeniu HPLC-ESI-QTOF-MS. O ile nie wskazano inaczej, komórki poddano odpowiednim analizom 3 dni po traktowaniu GSE w warunkach hodowli. cps, liczba na sekundę. Dane na wykresach słupkowych i krzywych regresji są przedstawione jako średnia ± odchylenie standardowe i są reprezentatywne dla trzech powtórzeń biologicznych. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Testy żywotności komórek wykazały, że GSE indukował starzejącą się śmierć komórek, ale nie proliferującą śmierć komórek, począwszy od stężenia 0,75 μg ml-1 (Figa. 1c). W stężeniu 7,50 μg ml-1, procent przeżywających starzejących się komórek spadł do około 10%, podczas gdy żywotność komórek proliferujących nie została naruszona nawet przy 15,00 μg ml-1 GSE (ryc. 1c), najwyższe stężenie stosowane w naszych testach komórkowych, co sugeruje wybitną selektywność i specyficzność GSE wobec starzejących się komórek, które są głównymi cechami senolityków. Następnie zmierzyliśmy zdolność GSE do zróżnicowanego namierzania starzejących się komórek w czasie. Po leczeniu GSE w stężeniu 3,75 μg ml-1, żywotność starzejących się komórek nie zmniejszyła się znacząco aż do 20 godzin. Różnica w żywotności między starzejącymi się komórkami a kontrolą (komórki proliferujące) osiągnęła maksimum po 32 h, co sugeruje niejednorodność wewnętrznej oporności na senolityki w starzejących się populacjach komórek (ryc. 1d). Ponieważ GSE generuje wyraźne efekty przeciwko starzejącym się komórkom, przeanalizowaliśmy skuteczność GSE w indukowaniu apoptozy komórek. Cytometria przepływowa wykazała znacznie zmniejszoną żywotność, podczas gdy apoptoza starzejących się komórek, ale nie komórek proliferujących, była podwyższona (ryc. 1e,f i uzupełniający rysunek. 2a). Dysfunkcja mitochondriów i zmiany metaboliczne są jednymi z charakterystycznych cech starzejących się komórek i starzenia się organizmu, zdarzeń powodujących stres oksydacyjny i produkcję reaktywnych form tlenu (ROS), takich jak ponadtlenek3,25. Użyliśmy MitoSOX Red, mitochondrialnego wskaźnika ponadtlenkowego26, w celu zbadania zmian międzykomórkowych i odkrył, że GSE promuje wytwarzanie mitochondrialnych ROS w starzejących się komórkach, ale nie w komórkach proliferujących (ryc. 1g). Zatem nasze dane są zgodne z modelem, w którym GSE zabija starzejące się komórki poprzez indukcję apoptozy i zaostrzenie stresu mitochondrialnego in vitro. Pestki winogron stanowią 38-52% suchej masy winogron i stanowią bogate źródło przeciwutleniaczy27. Zastosowaliśmy wysokociśnieniową chromatografię cieczową (HPLC) połączoną z kwadrupolową spektrometrią masową czasu przelotu (QTOF-MS) wyposażoną w interfejs elektrorozpylania jonizacji (ESI), aby zidentyfikować główne składniki GSE. Znaleźliśmy trzy główne kategorie fitochemikaliów, w tym kwasy fenolowe, flawonoidy (takie jak flawan-3-ol, procyjanidyny) i inne związki (ryc. 1h i tabela uzupełniająca 1). Wśród nich kilka składników zidentyfikowano jako procyjanidyny i ich pochodne, które, jak doniesiono, działają na białka mitochondrialne i łagodzą wiele chorób przewlekłych28. Jednak główny(e) składnik(i) pośredniczący(e) w senolitycznej funkcji GSE pozostaje w dużej mierze niejasny. Zgłoszone biologiczne aktywności procyjanidyn z pestek winogron obejmują redukcję uszkodzeń oksydacyjnych, tłumienie stanu zapalnego i indukcję apoptozy komórek rakowych29,30,31,32. Spośród poszczególnych związków występujących w GSE na szczególną uwagę zasługuje PCC1, gdyż wykazano, że indukuje uszkodzenia DNA, powoduje zatrzymanie cyklu komórkowego i zwiększa ekspresję kinaz punktów kontrolnych33. Dane ze wstępnej analizy (całkowity chromatogram jonowy) GSE, mieszaniny samych czynników fitochemicznych, metodą HPLC–QTOF-MS, sugerowały obecność PCC1, ponieważ profil GSE przy określonych pikach MS dopasowany do profilu chromatogramu chemicznie czystego PCC1 nabyte ze źródła komercyjnego (ryc. 1h i uzupełniający rysunek. 2b). Wykazano, że PCC1 obniża poziom BCL-2, ale zwiększa ekspresję regulatora BAX i aktywność kaspaz 3 i 9 w hodowanych komórkach nowotworowych, potencjalnie generując w ten sposób efekty przeciwnowotworowe poprzez indukcję apoptozy33. W związku z tym następnie oceniliśmy zdolność i selektywność PCC1 do eliminacji starzejących się komórek z hodowli. Dane sugerują, że PCC1 ma działanie senolityczne dla starzejących się komórek zrębu, zaczynając od stężenia 50 μM, przy którym komórki proliferujące pozostają w dużej mierze nienaruszone (ryc. 2a,b i tabela uzupełniająca 2). Chociaż wyższe stężenia powodowały niższy wskaźnik przeżywalności starzejących się komórek, przy progu około 200 μM, PCC1 wykazywał toksyczność w stosunku do komórek kontrolnych tylko wtedy, gdy był stosowany w stężeniu 600 μM lub wyższym (ryc. 2b). Przebieg w czasie aktywności kaspazy 3/7 wskazywał, że PCC1 wywierał działanie apoptotyczne w ciągu 12 godzin, osiągając plateau po 24 godzinach (ryc. 2c). To odkrycie było w dużej mierze zgodne z pomiarami żywotności (ryc. 2d). Senolityczny charakter PCC1 został potwierdzony przez komórki, które weszły w starzenie się z powodu wyczerpania replikacyjnego lub starzenia się (RS) lub onkogenu (HRAS).G12V) nadekspresja (OIS), która generuje stresujące zniewagi podobne do tych związanych ze starzeniem się wywołanym terapią (ryc. 2e, Rozszerzone dane Rys. 4b – e i tabela uzupełniająca 2). Razem, wyniki sugerują, że PCC1 selektywnie usuwa starzejące się ludzkie komórki zrębowe indukowane różnymi bodźcami w sposób zależny od dawki, ale bez znaczącego wpływu na niestarzejące się komórki, gdy jest stosowany w odpowiednich stężeniach. a, Pomiar przeżycia starzejących się komórek PSC27 przez barwienie SA-β-Gal. PCC1 stosowano w rosnących stężeniach. P wartości obliczono za pomocą jednokierunkowej analizy ANOVA z testem wielokrotnego porównania Tukeya. b, Przeżycie starzejących się komórek PSC27 indukowanych przez bleomycynę przy wzrastających stężeniach PCC1. C, Test apoptotyczny na aktywność kaspazy 3/7. D, Krzywe przeżycia przebiegu w czasie do oceny żywotności komórek PSC27 po leczeniu PCC1. i, Obrazy barwienia SA-β-Gal. TIS, starzenie wywołane terapią (przez bleomycynę). Skala, 20 μm. Dane są reprezentatywne dla trzech niezależnych eksperymentów. F, Cytometria przepływowa po obróbce z użyciem zestawu aneksyny V–FITC i PI oraz barwienie DAPI w celu określenia poziomu apoptozy. g, Kwantyfikacja odsetka żywotnych (Q4, PI−aneksyna V−) i apoptotyczne (Q2 i Q3, PI+aneksyna V+ i PI−aneksyna V+, odpowiednio) komórki po traktowaniu nośnikiem lub PCC1 przez 3 dni (n = 3 biologicznie niezależne testy). h, Barwienie immunofluorescencyjne komórek PSC27. RS indukowano przez seryjne pasażowanie przed leczeniem PCC1. czerwony, s.16INK4a. Komórki we wczesnym pasażu (P10) zastosowano jako kontrolę negatywną. ABT-263 (1,25 μM) był testowany jako kontrola pozytywna. Skala, 20 μm. i, Statystyka barwienia immunofluorescencyjnego. J, aktywność senolityczna indukowana przez PCC1 po inhibicji pankaspazy (20 μM QVD-OPh). do, test PD ludzkich MSC. PCC1 zastosowano w ósmym dniu po rozpoczęciu eksperymentów, jak wskazano. BLEO, bleomycyna. Do C,D,do, dane są przedstawione jako średnia ± odchylenie standardowe i pochodzą z trzech powtórzeń biologicznych (n = 3 niezależne testy). Dla danych w b-D,g,i,J, P wartości obliczono metodą dwustronną T-testy. W eksperymentach dla C-doPCC1 zastosowano w stężeniu 100 μM. O ile nie wskazano inaczej, próbki do analiz pobrano 3 dni po potraktowaniu PCC1. Dane na wykresach słupkowych są przedstawione jako średnia ± odchylenie standardowe i są reprezentatywne dla trzech powtórzeń biologicznych. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Aby eksperymentalnie rozszerzyć i ustalić skuteczność PCC1 w różnych liniach komórkowych, poddaliśmy działaniu PCC1 ludzkie płodowe fibroblasty płuc (WI38), pierwotne ludzkie komórki śródbłonka żyły pępowinowej (HUVEC) i ludzkie mezenchymalne komórki macierzyste (MSC) i stwierdziliśmy, że starzejące się komórki wszystkich tych linii podobna podatność na selektywną ablację przez PCC1, podczas gdy ich niestarzeniowe odpowiedniki pozostały żywotne (Extended Data Ryc. 4f–h i tabela uzupełniająca 3). Dalej potwierdziliśmy indukcję apoptozy w starzejących się komórkach w odpowiedzi na PCC1 za pomocą cytometrii przepływowej, podczas gdy PCC1 w dużej mierze nie wpływa na proliferujące komórki (ryc. 2f,g). Podsumowując, nasze dane pokazują, że PCC1 selektywnie eliminuje starzejące się komórki w różnych typach komórek i powstające z różnych wyzwalaczy starzenia. Aby zwizualizować zubożenie starzejących się komórek przez PCC1, zbadaliśmy ekspresję p16INK4a, szeroko stosowany marker starzenia w komórkach zrębu, które doświadczyły RS. PCC1 skutecznie usuwał starzejące się komórki p16-dodatnie, które pojawiły się tylko w populacjach PSC27 późnego pasażu, ze skutecznością w dużej mierze podobną do ABT-263 (1,25 μM), dobrze znanego syntetycznego środka senolitycznego18,21 (Figa. 2h,i). Aby udowodnić, że eliminacja starzejących się komórek za pośrednictwem PCC1 następuje głównie poprzez indukcję apoptozy, a nie przez inne formy zaprogramowanej śmierci komórek, potraktowaliśmy komórki inhibitorem apoptozy pankaspazy chinolilo-walilemTEN-metyloaspartylo-(-2,6-difluorofenoksy)-metyloketon (QVD-OPh). Zdolność PCC1 do zabijania starzejących się komórek została odwrócona przez QVD-OPh. PCC1 dzieli zatem indukcję apoptozy zależną od kaspazy jako cechę senolityczną z ABT-263 (ryc. 2j). Dalsza analiza z użyciem chemicznych inhibitorów wykluczyła śmierć komórek wywołaną przez PCC1 w wyniku ferroptozy, pyroptozy lub nekroptozy (Dane rozszerzone Ryc. 4i). Aby ocenić potencjał podwojenia populacji komórek (PD) po leczeniu lekami genotoksycznymi, zastosowaliśmy MSC, które mogą samoodnawiać się i wznowić proliferację opartą na koloniach, nawet po ekspozycji na stres środowiskowy34, prawdopodobnie ze względu na niejednorodność uszkodzeń, przy czym komórki doświadczają mniejszych uszkodzeń, prawdopodobnie są w stanie zachować zdolność do samoregeneracji i ponownego wejścia w cykl komórkowy24,35. W przeciwieństwie do komórek uszkodzonych bleomycyną, które szybko weszły w zatrzymanie wzrostu po leczeniu, leczenie PCC1 po starzeniu się znacznie zwiększyło zdolność MSC do PD, zwłaszcza po usunięciu starzejących się komórek rozwijających SASP i mających potencjał do indukowania starzenia parakrynnego w populacjach komórek (ryc. . 2k). Jednak leczenie PCC1 nie wpłynęło na PD proliferujących komórek, co dodatkowo wskazuje na selektywność PCC1 dla starzejących się komórek w porównaniu z ich normalnymi odpowiednikami. Ponieważ GSE jest złożoną mieszaniną fitochemiczną, a wiele jej składników wykazuje działanie przeciwutleniające i przeciwzapalne27,36, zbadaliśmy, czy PCC1 był głównym składnikiem GSE zaangażowanym w niszczenie starzejących się komórek, czy też alternatywne fitochemikalia w GSE mogą przyczynić się do jego ogólnego efektu senolitycznego. W tym celu zbadaliśmy wpływ poszczególnych cząsteczek fitochemicznych na przeżywalność starzejących się komórek PSC27. Większość składników GSE nie wykazywała aktywności senolitycznej w zakresie dawek PCC1 i nie powodowała znaczącej śmierci proliferujących komórek (rysunki uzupełniające. 3 oraz 4). Chociaż kwercetyna flawonoidowa wykazywała aktywność senolityczną, tak jak w naszych poprzednich badaniach, właściwość dzielona z naturalnymi flawonami11,21, „rekonstytuowany GSE”, składający się z głównych składników zmieszanych zgodnie z ich procentem masowym, jak wynika z naszych danych HPLC-QTOF-MS (tabela uzupełniająca 1, należy zauważyć, że kwercetyna stanowi tylko 0,9%), ale celowo wykluczając PCC1, nie wykazała podobnych wyników jak te obserwowane dla PCC1 w obu testach (rysunki uzupełniające 3 oraz 4). Chociaż nie możemy stwierdzić, czy inne składniki mają udział, nasze dane wyraźnie sugerują, że PCC1 jest głównym mediatorem senolitycznego efektu GSE. Biorąc pod uwagę znaczącą skuteczność PCC1 w selektywnym wywoływaniu starzejącej się śmierci komórek, zbadaliśmy mechanizm(y) leżący u podstaw. PCC1 należy do nadrodziny flawonoidów, które potrafią zmiatać wolne rodniki, chelatować metale i ograniczać powstawanie wodoronadtlenku, właściwości przeciwutleniające przypisywane w strukturze funkcyjnej grupie „-OH” oraz jej pozycji na pierścieniu cząsteczki flawonoidu27. Zdolność antyoksydacyjna procyjanidyn jest po części zależna od ich stopnia polimeryzacji, podczas gdy PCC1 jest z natury trimerem procyjanidyn epikatechiny (ryc. 3a). a, Struktura chemiczna trimerycznej epikatechiny PCC1. b, Heatmap przedstawiający górne geny (50) znacząco podwyższony w starzejących się komórkach PSC27, ale regulowany w dół po traktowaniu PCC1 (50 μM). Czerwone gwiazdki, czynniki SASP. C, wykres GSEA znaczącego zestawu genów w widmie SASP. FDR, wskaźnik fałszywych odkryć; NES, znormalizowany wynik wzbogacania. D, wykres GSEA znaczącego zestawu genów związanego z sygnalizacją za pośrednictwem NF-κB. i, NetworkAnalyst mapa interakcji białko-białko typowych czynników związanych z SASP znacznie podwyższonych w starzejących się komórkach, ale osłabionych przez leczenie PCC1. F, Mapa termiczna pokazująca zróżnicowaną ekspresję genów rodziny BCL-2 w starzejących się komórkach kontrolnych, starzejących się i traktowanych PCC1. g, Immunoblot komórek PSC27 wystawionych na działanie różnych czynników. Zbadano ekspresję czynników proapoptotycznych i antyapoptotycznych oraz cząsteczek związanych z sygnalizacją DDR. kaspaza 3 (t), kaspaza całkowita 3; kaspaza 3 (c), cięta kaspaza 3; p, fosforylowany. β-aktyna i GAPDH, kontrole ładowania. Dane są reprezentatywne dla trzech niezależnych eksperymentów. h, Komórki zostały zakażone trzema różnymi celowanymi gatunkami RNA o krótkiej strukturze spinki do włosów OBRAŻENIA lub PUMA przed ekspozycją na bleomycynę w celu wywołania starzenia. Siedem dni później komórki traktowano PCC1 (100 μM) przez okres 3 dni w celu wywołania apoptozy. SCR, mieszanie. i, OBRAŻENIA ekspresję określono metodą ilościowej PCR z odwrotną transkrypcją (RT–qPCR). Komórki traktowano bleomycyną w celu wywołania starzenia przed ekspozycją na 100 μM PCC1 przez 3 dni w nieobecności lub w obecności 10 μM MK2206, 10 μM ruksolitynibu lub 20 nM BMS-582949 w celu zahamowania aktywności AKT, JAK1 i/lub JAK2 lub p38 MAPK, odpowiednio. J, Podobny zestaw testów ekspresji RT–qPCR dla PUMA stosując warunki opisane w i. do-m, Pomiar żywotności komórek po traktowaniu PCC1 przy braku lub w obecności MK2206 (do), ruksolitynib (L) lub BMS-582949 (m), w tym hamowanie aktywności enzymatycznej odpowiednio AKT, JAK1 i/lub JAK2 lub p38 MAPK. Dla danych w C,D, P wartości obliczono za pomocą jednokierunkowej analizy ANOVA z porównaniem post hoc Tukeya. Istotność statystyczna w h-m obliczono za pomocą dwustronnego T-testy lub jednokierunkowa ANOVA (test Dunnetta). Dane na wszystkich wykresach słupkowych są przedstawione jako średnia ± odchylenie standardowe i reprezentują trzy powtórzenia biologiczne. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Najpierw przeanalizowaliśmy wpływ PCC1 na ekspresję starzejących się komórek w całym transkryptomie. Bioinformatyka wykazała, że 4406 genów uległo znacznej regulacji w górę, a 2766 genów było w dół w komórkach zrębu po traktowaniu PCC1 (rysunek uzupełniający 5a). Zaobserwowaliśmy dużą liczbę czynników SASP, których ekspresja była znacznie podwyższona podczas starzenia się komórek, ale znacznie obniżona, gdy starzejące się komórki wystawiono na działanie PCC1 (ryc. 3b). Profilowanie GSEA wykazało, że zarówno sygnatury SASP, jak i NF-κB zostały znacząco stłumione przez traktowanie PCC1 (ryc. 3c,d). Ponadto zauważyliśmy wiele wzajemnych interakcji lub powiązań funkcjonalnych między tymi czynnikami, które uległy regulacji w górę podczas starzenia i w dół po leczeniu PCC1, które pojawiły się na liście genów o najwyższej ekspresji różnicowej, z których większość była typowymi czynnikami wydzielanymi (ryc. 3e). Aby zrozumieć selektywność PCC1 dla starzejących się komórek, dokonaliśmy dalszej oceny profilu ekspresji transkryptomicznej i zauważyliśmy, że PCC1 indukował zmiany ekspresji u kilku członków nadrodziny BCL-2 (ryc. 3f). Chociaż sygnalizacja DDR pozostała w dużej mierze niezmieniona, zaobserwowano zależne od PCC1 zwiększenie lub aktywację kinazy białkowej aktywowanej mitogenem p38 (MAPK), z rozszczepieniem kaspazy 3 występującym w tych komórkach (ryc. 3g). Chociaż ekspresja BCL-xL była podwyższona w starzejących się komórkach w porównaniu z ich proliferującymi kontrolami, traktowanie PCC1 nie zwiększyło dodatkowo poziomu białka. Poziomy pozostałych dwóch czynników BCL-2, a mianowicie BCL-2 i BAX, pozostały w dużej mierze niezmienione. Podczas gdy NOXA i PUMA (dwóch członków podrodziny proapoptotycznej domeny 3 homologicznej do BCL-2 (BH3)) wykazywało różne wzorce ekspresji podczas starzenia komórkowego, leczenie PCC1 spowodowało podwyższenie poziomu obu czynników (ryc. 3g). Zniesienie czynników proapoptotycznych BCL-2 sugerowało, że NOXA i PUMA częściowo pośredniczą w senolitycznym działaniu PCC1 (ryc. 3h i rozszerzone dane Rys. 5a–c). Leczenie chemicznymi inhibitorami kinazy AKT, kinazy Janus (JAK)1, JAK2 i p38 MAPK również sugerowało udział tych szlaków sygnałowych w ekspresji PMAIP1 (OBRAŻENIA) oraz BBC3 (PUMA) i apoptoza starzejących się komórek po leczeniu PCC1 (ryc. 3i–m). Jak powalenie OBRAŻENIA oraz PUMA tylko częściowo hamował działanie senolityczne PCC1 (ryc. 3h, k – m), zbadaliśmy inne możliwe mechanizmy prowadzące do śmierci starzejącej się komórki. Ponieważ procyjanidyny zwykle zwiększają żywotność komórek, zmniejszają produkcję ROS i ograniczają stres oksydacyjny w komórkach ssaków37,38, następnie zapytaliśmy, czy podobne lub przeciwutleniające efekty można zaobserwować w starzejących się komórkach wystawionych na działanie PCC1. Co zaskakujące, odkryliśmy, że było odwrotnie, ponieważ starzejące się komórki PSC27 wykazywały podwyższone poziomy ROS po potraktowaniu PCC1, w przeciwieństwie do ich proliferujących odpowiedników (ryc. 4a i rozszerzone dane Rys. 5d, zwróć uwagę na sygnały z sondy z dioctanu 2′-7′-dichlorodihydrofluoresceiny (DCFH-DA). Leczenie HS-1793, stabilnym analogiem resweratrolu, który ma działanie wymiatające wolne rodniki39, skutecznie blokował wytwarzanie ROS w starzejących się komórkach traktowanych PCC1 (Extended Data Fig. 5e,f), podczas gdy poziomy ROS wzrosły dalej po ekspozycji starzejących się komórek traktowanych PCC1 na CCCP, protonofor mitochondrialny rozprzęgacz40lub ruksotemid (LTX-315), amfipatyczny peptyd kationowy, który indukuje permeabilizację zewnętrznej błony mitochondrialnej41, każdy stosowany w stężeniach, które nie były cytotoksyczne dla komórek kontrolnych (rys. 5e,f). Chociaż leczenie CCCP lub ruksotemidem per se również powodowało zwiększone wytwarzanie ROS, efekty były generalnie mniejsze niż te wywoływane przez PCC1, co sugeruje, że PCC1 wyzwala dysfunkcję mitochondriów w starzejących się komórkach. Mierząc wskaźnik apoptozy starzejących się komórek (aktywność kaspazy 3/7), stwierdziliśmy, że efekt indukowany przez PCC1 może być dodatkowo wzmocniony po połączeniu PCC1 z każdym mitochondrialnym czynnikiem zakłócającym, ale stłumiony po równoczesnym leczeniu z HS-1793 (rys. rozszerzonych danych . 5g). a, Pomiar poziomu ROS za pomocą DCFH-DA, przepuszczalnej dla komórek sondy fluorescencyjnej wrażliwej na zmiany komórkowego stanu redoks. Eksperymenty przeprowadzono 1 dzień po potraktowaniu PCC1. Po lewej, reprezentatywne obrazy. Skala, 10 μm. Racja, statystyki. DCF, dichlorodihydrofluoresceina. b, Immunoblot po ekspozycji komórek na różne zabiegi. Dystrybucja cytochromu c między mitochondriami a cytoplazmą była profilowana przez izolację mitochondriów z supernatantów cytozolu 3 dni po potraktowaniu PCC1. COX IV jest końcowym enzymem mitochondrialnego łańcucha oddechowego i markerem mitochondrialnym. C, Krzywe przeżycia przebiegu w czasie do oceny żywotności komórek PSC27 po traktowaniu PCB2, innym członkiem naturalnej rodziny procyjanidyn. Dane są przedstawione jako średnia ± odchylenie standardowe i pochodzą z trzech powtórzeń biologicznych (n = 3 niezależne testy). D, test produkcji ROS przeprowadzony w podobny sposób, jak opisano w a, z tym wyjątkiem, że komórki zostały wystawione na działanie PCB2. Skala, 10 μm. i, Immunoblot ekspresji i dystrybucji ATM, p53 i kaspazy 3 między cytoplazmą a jądrem. GAPDH i lamina A/C, kontrole ładowania odpowiednio dla cytoplazmy i jąder. C1, PCC1; B2, PCB2. F, Mikroskopia konfokalna barwienia immunofluorescencyjnego po potraktowaniu komórek nośnikiem (DMSO) lub PCC1. Zastosowano przeciwciała pierwszorzędowe specyficzne dla p53 lub COX IV. Skala, 10 μm. g, Analiza immunoblot komórek PSC27 wystawionych na działanie różnych czynników. Cyto, cytoplazmatyczne; mito, mitochondrialny. h, Analiza barwienia JC-1, sonda fluorescencyjna wskazująca na Δψm. Sygnały mierzono przez 3 dni. Zielona fluorescencja wskazuje na monomery JC-1 (pojawiają się one w cytozolu po depolaryzacji błony mitochondrialnej i wskazują na wczesny etap apoptozy). Czerwona fluorescencja wskazuje na agregację JC-1 (znajduje się w nienaruszonych mitochondriach). Po lewej, reprezentatywne obrazy. Racja, statystyki. W odpowiednich testach zastosowano zarówno PCC1, jak i PCB2 w stężeniu 100 μM. Dane w b,i-g reprezentują trzy niezależne eksperymenty. Istotność statystyczna w a (prawidłowy), D (po prawej) i h (po prawej) został obliczony za pomocą dwustronnego T-testy, i to w C obliczono za pomocą jednokierunkowej analizy ANOVA (test Dunnetta). Dane na wszystkich wykresach słupkowych są przedstawione jako średnia ± odchylenie standardowe i są reprezentatywne dla trzech powtórzeń biologicznych. NS, P > 0,05; *P <0,05; **P <0,01. Uwalnianie cytochromu c i rozerwanie błony mitochondrialnej są zdarzeniami wewnątrzkomórkowymi związanymi z apoptozą i często działają jako bezpośrednie czynniki napędzające apoptozę42. Nasze dane sugerują, że leczenie PCC1 zwiększyło uwalnianie cytochromu c z mitochondriów do otaczającej przestrzeni cytoplazmatycznej (ryc. 4b i rozszerzone dane Rys. 5h). Uwalnianie cytochromu c z mitochondriów jest w dużej mierze zgodne z reakcjami biochemicznymi, takimi jak aktywacja kaspazy w starzejących się komórkach traktowanych PCC1 (ryc. 3g). Członkowie rodziny procyjanidyn wykazują szerokie spektrum właściwości farmakologicznych, w tym przeciwutleniające i przeciwzapalne, które są przeciwieństwem tego, co zaobserwowaliśmy podczas leczenia starzejących się komórek za pomocą PCC1. Obecne dane skłoniły nas do wyjaśnienia, czy działanie PCC1 jest odtwarzane przez inne procyjanidyny. Procyjanidyna B2 (PCB2) jest reprezentatywnym flawonoidem, który występuje jako dimer i obniża poziom ROS podczas stresu oksydacyjnego w hodowanych komórkach43. PCB2 nie zdołało wyeliminować starzejących się komórek (ryc. 4c i Rysunki uzupełniające. 3b oraz 4b) i ani nie nasilały produkcji ROS ani nie indukowały mitochondrialnego uwalniania cytochromu c w starzejących się komórkach (ryc. 4d i rozszerzone dane Rys. 5i). Znaczna ilość p65 (RelA), jednej z głównych podjednostek kompleksu NF-κB, została przeniesiona do jądra starzejących się komórek (ryc. 4e). Chociaż traktowanie PCB2 przeciwdziałało translokacji jądrowej p65, co jest zgodne z jego zdolnością przeciwzapalną, efekt ten nie został odtworzony przez PCC1 (ryc. 4e). Starzejące się komórki wystawione na działanie PCC1 wykazywały niezwykłe rozszczepienie kaspazy 3, podczas gdy te poddane działaniu PCB2 nie, co dodatkowo różnicowało aktywność biologiczną tych dwóch cząsteczek procyjanidyn (ryc. 4e). Jako czynnik, który funkcjonalnie reguluje los komórek, p53 może indukować apoptozę poprzez transaktywację genów proapoptotycznych lub w sposób niezależny od transkrypcji poprzez translokację do mitochondriów44. Zaobserwowaliśmy zwiększoną translokację jądrową p53 po starzeniu się komórek, wzorzec znacznie zmniejszony przez PCC1, ale znacznie mniej niż przez PCB2 (ryc. 4e, f). Ponieważ wykluczenie jądrowe p53 jest krytycznym krokiem w indukcji apoptozy starzejących się komórek45, oceniliśmy dalej rozkład p53. Barwienie immunofluorescencyjne wykazało znacznie zwiększone nakładanie się p53 z podjednostką IV oksydazy cytochromu c (COX IV) (transbłonowy kompleks białkowy w mitochondrialnym oddechowym łańcuchu elektronowym, często używany jako marker białkowy rezydujący w mitochondriach) w starzejących się komórkach traktowanych PCC1, co sugeruje zwiększoną translokację p53 do macierzy mitochondrialnej. Chociaż obserwowaliśmy pewne p53 w mitochondriach proliferujących komórek, PCC1 nie indukował znaczącego ani kompleksowego napływu białka p53 do mitochondrialnej macierzy proliferujących komórek (ryc. 4f). Jednak w starzejących się komórkach poziomy p53 były obniżone w jądrach, ale wzrosły w mitochondriach po ekspozycji na PCC1 (ryc. 4g). Spadek potencjału błony mitochondrialnej (Δψm) jest zdarzeniem, które może wywołać apoptozę poprzez wewnętrzny szlak mitochondrialny46. Stwierdziliśmy, że Δψm było znacznie zmniejszone w starzejących się komórkach, podczas gdy komórki proliferujące pozostały zasadniczo nienaruszone w obecności PCC1, na co wskazuje profil sygnałów sondy JC-1 (ryc. 4h). Tak więc PCC1 promuje wytwarzanie ROS, wyzwala uwalnianie cytochromu c i powoduje zaburzenia Δψm w starzejących się komórkach, zdarzenia nieodłącznie związane z niepełnosprawnością mitochondriów i funkcjonalnie napędzają apoptozę komórek. Razem, nasze dane eksperymentalne sugerują, że starzejące się komórki podlegają apoptozie indukowanej przez PCC1, procesowi częściowo pośredniczonemu przez OBRAŻENIA oraz PUMA regulacja w górę i związana ze zwiększoną produkcją ROS i dysfunkcją mitochondriów. Biorąc pod uwagę zdolność i selektywność PCC1 do eliminowania starzejących się komórek in vitro, następnie zbadaliśmy, czy ten czynnik może być wykorzystany do interwencji przeciwko patologiom związanym z wiekiem in vivo. W onkologii klinicznej oporność na leki ogranicza skuteczność większości terapii przeciwnowotworowych, podczas gdy starzejące się komórki często przyczyniają się do oporności terapeutycznej poprzez rozwój SASP in vivo w mikrośrodowisku guza uszkodzonego przez lek (TME).15,16,47. Farmakologiczna eliminacja starzejących się komórek wywołanych terapią minimalizuje skutki uboczne chemioterapii i zapobiega nawrotom raka u zwierząt48. Jednak możliwość zmniejszenia liczby starzejących się komórek z guzów pierwotnych za pośrednictwem PCC1 w celu zwiększenia skuteczności terapii przeciwnowotworowych pozostaje w dużej mierze nieznana. Po pierwsze, zdecydowaliśmy się zbudować rekombinanty tkankowe poprzez zmieszanie komórek PSC27 z komórkami PC3, które są typową linią komórkową raka prostaty o wysokim stopniu złośliwości, we wstępnie zoptymalizowanym stosunku (1:4)14. Komórki następnie wszczepiono podskórnie w tylny bok myszy z nieotyłą cukrzycą i ciężkim złożonym niedoborem odporności (NOD-SCID). Guzy zwierząt mierzono pod koniec 8-tygodniowego okresu i pobrano tkanki do oceny patologicznej. W porównaniu z nowotworami zawierającymi komórki rakowe PC3 i naiwne komórki zrębowe PSC27, heteroprzeszczepy złożone z komórek PC3 i starzejących się komórek PSC27 wykazywały znacznie zwiększoną objętość, potwierdzając działanie starzejących się komórek promujące wzrost guza (Dane rozszerzone Ryc. 6a). Aby naśladować warunki kliniczne, eksperymentalnie zaprojektowaliśmy przedkliniczny schemat obejmujący terapie genotoksyczne i/lub leki senolityczne (ryc. 5a). Dwa tygodnie po wszczepieniu podskórnym, gdy zaobserwowano stabilny wychwyt guzów in vivo, podawano pojedynczą dawkę mitoksantronu (MIT, lek chemioterapeutyczny) lub placebo w 1. dniu 3., 5. i 7. tygodnia do końca schemat 8-tygodniowy (Dane rozszerzone Ryc. 6b). W przeciwieństwie do grupy otrzymującej placebo, podawanie MIT znacznie opóźniło wzrost guza, potwierdzając skuteczność MIT jako środka chemioterapeutycznego (44,0% zmniejszenie wielkości guza) (ryc. 5b). Warto zauważyć, że chociaż samo podawanie PCC1 nie powodowało zmniejszenia guza, leczenie MIT, a następnie podawanie PCC1 (w dawce 20 mg na kg przez wstrzyknięcie dootrzewnowe (ip) 2 tygodnie po pierwszej dawce MIT, a następnie dostarczanie co dwa tygodnie) znacznie zwiększyło regresję guza (55,2) % zmniejszenie wielkości guza w porównaniu z samym MIT; 74,9% zmniejszenie objętości guza w porównaniu z leczeniem placebo) (ryc. 5b). a, Przykładowy schemat schematu przedklinicznego. Dwa tygodnie po wszczepieniu podskórnym i wychwytywaniu in vivo rekombinantów tkankowych samce myszy NOD-SCID otrzymywały pojedyncze (mono) lub połączone (podwójne) środki w schemacie metronomicznym złożonym z kilku cykli. BLI, obrazowanie bioluminescencyjne. b, Statystyczne profilowanie objętości końcowych guzów. Komórki PC3 przeszczepiono samodzielnie lub razem z komórkami PSC27 do tylnego boku zwierząt. C, Porównawcza ocena starzenia in vivo przez barwienie SA-β-Gal. Nowotwory świeżo wycięto po uśmierceniu zwierząt i przetworzono jako zamrożone skrawki do barwienia histologicznego. Skala, 200 μm. D, Wykresy skrzypiec przedstawiające statystyki porównawcze barwienia SA-β-Gal w tkankach guza. i, Test transkryptu ekspresji in vivo kilku kanonicznych czynników SASP w komórkach zrębu izolowanych z guzów. Tkanki pochodzące od zwierząt, którym przeszczepiono ksenogenicznie komórki zarówno zrębowe, jak i nowotworowe, poddano izolowaniu z użyciem laserowej mikrodysekcji i kolejnym procesom. Dane są reprezentatywne dla trzech biologicznych replikacji (n = 10 zwierząt na grupę). Zestawy danych są wyświetlane jako wykresy pudełkowo-wąsowe, na których ramka rozciąga się od 25. do 75. percentyla z medianą pokazaną jako linia pośrodku i wąsami wskazującymi najmniejsze i największe wartości. F, Profilowanie transkryptów SASP w komórkach zrębu. Sygnały odpowiadające każdemu czynnikowi znormalizowano do tych z grupy traktowanej nośnikiem. Notatka p16INK4a jest również znany jako CDKN2A oraz p21CIP1 jest również znany jako CDKN1A. g, Statystyczny pomiar komórek z uszkodzonym DNA i komórek apoptotycznych w biopróbkach pobranych zgodnie z opisem w a,b. Wartości przedstawiono jako odsetek komórek pozytywnie wybarwionych metodą immunohistochemiczną (IHC) przeciwciałami swoistymi dla histonu γH2AX lub kaspazy 3 (rozszczepionych). Do b,D-g, P wartości obliczono metodą dwustronną T-testy. h, Reprezentatywne obrazy IHC kaspazy 3 (rozszczepionej, CC3) na końcu reżimów terapeutycznych. Skala, 100 μm. i, Przeżycie porównawcze myszy zabitych po rozwinięciu się zaawansowanych chorób o dużych rozmiarach. Czas przeżycia obliczono od czasu wstrzyknięcia rekombinowanej tkanki do śmierci zwierzęcia. MS, mediana przeżycia. P wartości obliczono za pomocą dwustronnych testów log-rank (Mantel-Cox). Dane w C,h reprezentują trzy niezależne eksperymenty. Dane na wszystkich wykresach słupkowych są przedstawione jako średnia ± odchylenie standardowe i są reprezentatywne dla trzech powtórzeń biologicznych. Następnie zbadaliśmy, czy w ogniskach nowotworowych tych zwierząt występuje starzenie się komórek. Nic dziwnego, że podawanie MIT wywołało pojawienie się dużej liczby starzejących się komórek w tkance nowotworowej. Jednak dostarczenie PCC1 tym zwierzętom poddanym chemioterapii spowodowało zubożenie większości starzejących się komórek (ryc. 5c,d). Mikrodysekcja wychwytu laserowego, a następnie testy transkryptów wykazały znacznie zwiększoną ekspresję czynników SASP, w tym: IL6, CXCL8, SPINK1, WNT16B (znany również jako WNT16), GM-CSF (znany również jako CSF2), MMP3 oraz IL1A, tendencja, której towarzyszy regulacja w górę genu kodującego marker starzenia p16INK4a u zwierząt leczonych chemioterapią (ryc. 5e i rozszerzone dane Rys. 6c). Zmiany te obserwowano głównie w komórkach zrębu, a nie w sąsiednich komórkach nowotworowych, co sugeruje możliwość ponownego zaludnienia pozostałych komórek nowotworowych, które często rozwijają oporność nabytą w TME uszkodzonym przez leczenie. Jednak po podaniu PCC1 zmiany związane z SASP zostały w dużej mierze odwrócone, jak sugerują testy transkryptów i sekwencja RNA (ryc. 5f i rozszerzone dane Rys. 6d). Aby zbadać mechanizmy leżące u podstaw ekspresji SASP u myszy leczonych MIT, wycięliśmy guzy od zwierząt leczonych tymi dwoma środkami 7 dni po podaniu pierwszej dawki GSE, czyli w punkcie czasowym przed rozwojem opornych kolonii. W przeciwieństwie do leczenia placebo, podawanie MIT zwiększyło uszkodzenia DNA i apoptozę, podczas gdy leczenie samym PCC1 nie (ryc. 5g). Jednakże, gdy zwierzętom leczonym MIT podawano jednocześnie PCC1, uszkodzenie DNA i apoptoza były znacznie nasilone, co sugeruje zwiększoną cytotoksyczność u zwierząt otrzymujących zarówno chemioterapię, jak i leki senolityczne. Jako dowód potwierdzający, zaobserwowaliśmy podwyższone rozszczepienie kaspazy 3, typową cechę apoptozy komórkowej, gdy PCC1 podawano razem z MIT (ryc. 5h). Następnie oceniliśmy konsekwencje progresji nowotworu, porównując przeżycie różnych grup zwierząt w czasie. W tej przedklinicznej kohorcie zwierzęta monitorowano pod kątem wzrostu guza, przy czym uznano, że masywna choroba pojawiła się po wyraźnym obciążeniu guzem (rozmiar ≥ 2000 mm3), podejście stosowane we wcześniejszych badaniach14,49. Myszy otrzymujące leczenie skojarzone MIT–PCC1 wykazywały najbardziej wydłużoną medianę przeżycia, przeżywając co najmniej 48,1% dłużej niż grupa leczona samym MIT (ryc. 5i, zielony kontra niebieski). Jednak samo leczenie PCC1 tylko nieznacznie wydłużyło przeżycie. Nasze dane sugerują, że podawanie samego PCC1 nie zmienia wzrostu guza ani nie sprzyja przeżywalności zwierząt, podczas gdy jednoczesne podawanie PCC1 z MIT ma znaczące efekty synergistyczne. Należy zauważyć, że leczenie przeprowadzone w tych badaniach wydawało się być dobrze tolerowane przez zwierzęta, ponieważ nie zaobserwowano żadnych znaczących zaburzeń poziomu mocznika, kreatyniny lub enzymów wątrobowych ani masy ciała (Dane rozszerzone Rys. 6e,f). Co ważniejsze, środki chemioterapeutyczne i geroochronne podawane w dawkach zoptymalizowanych w tym badaniu nie zaburzały znacząco integralności układu odpornościowego ani homeostazy tkanek narządów krytycznych, nawet u myszy immunokompetentnych (rysunek uzupełniający 6a–c). Wyniki te potwierdzają uzasadnienie, że środki przeciwstarzeniowe w połączeniu z konwencjonalną chemioterapią mogą potencjalnie wzmocnić odpowiedź guza bez powodowania poważnej toksyczności ogólnoustrojowej. Nawet niewielka liczba starzejących się komórek może wywołać dysfunkcję fizyczną u młodych zwierząt50. Zapytaliśmy, czy PCC1 selektywnie zabija starzejące się komórki in vivo i może w ten sposób zapobiegać dysfunkcjom fizycznym. Aby odpowiedzieć na to pytanie, przeprowadziliśmy równoległą implantację kontrolnych i starzejących się embrionalnych fibroblastów myszy (MEF, 0,5 × 106 komórek na stronę) konstytutywnie eksprymujących lucyferazę (LUC+) podskórnie do syngenicznych myszy typu dzikiego (WT). Natychmiast po implantacji zwierzęta leczono PCC1 (w dawce 20 mg na kg przez wstrzyknięcie ip) lub nośnikiem (etanol-glikol polietylenowy 400-Phosal 50 glikol propylenowy (PG) o 10:30:60) przez 7 dni (ryc. 6a). Stwierdziliśmy, że intensywność sygnału luminescencji była znacznie niższa u myszy, którym wszczepiono starzejące się komórki i którym podano PCC1 niż u myszy z miotu, którym wszczepiono podłoże, chociaż nie zaobserwowano żadnej różnicy po leczeniu myszy, którym przeszczepiono LUC+ komórki kontrolne (ryc. 6b,c), potwierdzające skuteczność senolityczną PCC1 in vivo. a, Schemat procedur eksperymentalnych transplantacji komórek i testów funkcji fizycznych u 5-miesięcznych samców myszy C57BL/6J. b, Reprezentatywne obrazy przedstawiające aktywność lucyferazy in vivo 2 dni po ostatnim leczeniu myszy. Skala, 20 mm. C, Luminescencja przeszczepionych komórek jako odsetek w stosunku do średnich sygnałów u zwierząt, którym podawano nośnik. D-F, Pomiar maksymalnej prędkości chodu (w stosunku do linii bazowej) (D), wytrzymałość wisząca (i) i siłę chwytu (F) u 5-miesięcznych samców myszy C57BL/6J, z testami przeprowadzonymi 1 miesiąc po ostatnim leczeniu. g, Schemat eksperymentalnego projektu dla pomiarów transplantacji i funkcji fizycznych. h-J, Pomiar maksymalnej prędkości chodu (w stosunku do linii bazowej) (h), wytrzymałość wisząca (i) i siłę chwytu (J) u 28-tygodniowych samców myszy C57BL/6J (2 tygodnie po ostatnim leczeniu). do, Krzywe przeżycia rocznego 17-miesięcznych zwierząt, którym wszczepiono implant 0,5 × 106 kontrolne komórki MEF i traktowane nośnikiem (podłoże CTRL) i myszy z wszczepionym 0,5 × 106 starzejące się komórki MEF potraktowane nośnikiem (nośnik SEN) lub PCC1 (SEN-PCC1). Czerwone groty strzałek, implantacja komórek (w 528. dniu życia) lub koniec pomiaru przeżycia (890. dzień życia). P wartości obliczono za pomocą dwustronnych testów log-rank (Mantel-Cox). L, Porównawcza ocena ilościowa obciążenia chorobą (po lewej) i guza (po prawej) (przedstawiona jako mediana w zakresie międzykwartylowym) po implantacji starzejących się komórek i leczeniu nośnikiem lub PCC1. m, Przyczyna śmierci u zwierząt, które otrzymały wszczepione komórki i były leczone nośnikiem lub PCC1. Do D-F,h-J, dane są pokazane jako wykresy pudełkowe, na których prostokąty rozciągają się od 25. do 75. percentyla z medianą pokazaną jako linia pośrodku, a wąsy wskazują wartości najmniejsze i największe. Do C-F,h-J, P wartości obliczono metodą dwustronną T-testy. Ilość zwierząt, n = 5 na grupę za C, n = 10 na grupę za D-J, n = 27 dla do oraz n = 13 dla L,m. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Następnie zbadaliśmy, czy zabijanie wszczepionych starzejących się komórek przy użyciu PCC1 może złagodzić zdarzenia patologiczne, w szczególności dysfunkcję fizyczną. Leczenie młodych zwierząt PCC1 po wszczepieniu starzejących się komórek przez 1 tydzień zapobiegło spadkowi maksymalnej prędkości chodu (RotaRod), wytrzymałości na zwisanie (test wiszenia) i siły chwytu (metr chwytu), zmian obserwowanych w ciągu 1 miesiąca po podaniu innej grupie myszy niosących podłoże starzejące się komórki, zgodne z potencjałem PCC1 do zmniejszania dysfunkcji fizycznej (ryc. 6d–f). Podawanie PCC1 zapobiegało również dysfunkcji fizycznej, która wystąpiła u zwierząt 5 tygodni po implantacji starzejących się komórek (Fig. 6g). U myszy niosących starzejące się komórki, pojedynczy 5-dniowy cykl leczenia PCC1 poprawił sprawność fizyczną w porównaniu z leczeniem nośnikiem (ryc. 6 rano - d). Warto zauważyć, że poprawa była wykrywalna 2 tygodnie po leczeniu PCC1, a nawet utrzymywała się przez kilka miesięcy (Dane rozszerzone Ryc. 7a,b). W tych dwóch punktach czasowych podawania PCC1 (bezpośrednio w porównaniu z 5 tygodniami po implantacji starzejących się komórek) korzystne efekty PCC1 wydawały się być porównywalne. Dane sugerują, że harmonogram podawania PCC1 może być elastyczny, co wskazuje na jego potencjalną wykonalność kliniczną. Ponieważ procyjanidyny pochodzące z nasion roślin mają zwykle okres półtrwania w fazie eliminacji <12 h51,52, taka trwała poprawa sprawności fizycznej po pojedynczym cyklu leczenia PCC1 omija potrzebę ciągłego leczenia środkiem senolitycznym, co dalej sugeruje, że aktywność PCC1 jest wystarczająca do zapobieżenia dysfunkcji fizycznej wywołanej przez starzejące się komórki. Następnie staraliśmy się ocenić wpływ starzejących się komórek lub korzyści z ich eliminacji u zwierząt w średnim wieku. W tym celu wykorzystaliśmy 17-miesięczne myszy C57BL/6J, którym wszczepiono kontrolne lub starzejące się MEF. Warto zauważyć, że przeżycie zwierząt niosących starzejące się komórki i otrzymujących leczenie nośnikiem w następnym roku było znacznie niższe niż zwierząt otrzymujących leczenie PCC1, przy 2,4-krotnie wyższym ryzyku śmierci (współczynnik ryzyka, P = 0,0172) (ryc. 6k). Jednak obciążenie chorobą, obciążenie guzem w momencie śmierci i przyczyny zgonu nie różniły się znacząco między myszami leczonymi nośnikiem i tymi leczonymi PCC1 (Fig. 6l,m). Dane te sugerują, że niewielka liczba starzejących się komórek może wpływać na przeżycie poprzez ogólny proces, taki jak przyspieszenie postępu starzenia, a nie powodowanie określonej patologii lub kilku indywidualnych stanów. Zwiększenie obciążenia starzejącymi się komórkami powoduje dysfunkcję fizyczną, tendencję związaną ze śmiertelnością w średnim wieku, ale można ją opóźnić przez podanie leków senolitycznych, takich jak PCC1. Senolityki zubożają starzejące się komórki w różnych tkankach i narządach w różnych sytuacjach patofizjologicznych, z których większość jest skorelowana ze starzeniem się53. Aby dokładniej zbadać wpływ PCC1 na starzejące się komórki w organizmach i starzenie się organizmu, wybraliśmy dwa niezależne zwierzęce modele starzenia się in vivo, w tym myszy poddane terapii i myszy naturalnie starzejące się. Po pierwsze, indukowaliśmy starzenie się komórek, wystawiając myszy WT na napromienianie całego ciała (WBI) w dawce subletalnej (5 Gy), po którym nastąpiło geroprotekcyjne traktowanie PCC1 (20 mg na kg przez wstrzyknięcie ip) lub nośnikiem (etanol-polietylen). glikol 400–Phosal 50 PG o 10:30:60) (raz w tygodniu) (ryc. 7a). Należy zauważyć, że zwierzęta, które przeszły WBI, wykazywały nieprawidłowy wygląd ciała, w tym wyraźnie siwe włosy, które jednak zostały w dużej mierze odwrócone po podaniu PCC1 (ryc. 7b,c). Starzejące się komórki SA-β-Gal-dodatnie indukowano in vivo u tych zwierząt, o czym świadczy zwiększona dodatnia barwa w tkankach serca i płuc (Fig. 7d, e). Jednakże, gdy leczyliśmy PCC1 przez wstrzyknięcie ip, odsetek komórek SA-β-Gal-dodatnich w wyciętych tkankach był znacznie zmniejszony, w przeciwieństwie do myszy, którym podawano nośnik na etapie po WBI (Fig. 7f,g). Leczenie PCC1 zmniejszyło również ekspresję markerów starzenia i podzbioru kluczowych czynników SASP w porównaniu z leczeniem nośnikiem (ryc. 7h). Podsumowując, dane sugerują, że PCC1 może skutecznie zubożać komórki SA-β-Gal-dodatnie, kontrolować ekspresję SASP i minimalizować obciążenie starzejącymi się komórkami w warunkach in vivo u myszy. a, Schemat procedury eksperymentalnej dla myszy poddanych testom WBI i sprawności fizycznej. b, Porównanie migawek całego ciała samców myszy C57BL/6J, które były naiwne, odpowiednio wystawione na WBI, a następnie potraktowane nośnikiem lub wystawione na WBI i leczone PCC1. C, Zdjęcie zwierząt w klatce opisane w a w warunkach przedklinicznych. D, Reprezentatywne obrazy barwienia SA-β-Gal tkanki serca myszy nieleczonych (naiwnych) i leczonych WBI, poddanych działaniu nośnika lub PCC1. Skala, 200 μm. i, Reprezentatywne obrazy barwienia SA-β-Gal tkanki płucnej myszy, jak opisano w D. Skala, 200 μm. F, Statystyka porównawcza barwienia SA-β-Gal tkanki sercowej zwierząt badanych w D. g, Statystyka porównawcza barwienia SA-β-Gal tkanki płucnej zwierząt przebadanych w i. h, Ilościowy pomiar ekspresji SASP na poziomie transkrypcji w tkankach pobranych od zwierząt leczonych w warunkach opisanych w a. i,J, Pomiar dystansu biegu na bieżni (i) i siłę chwytu (J) myszy doświadczalnych. Do F-J, P wartości obliczono metodą dwustronną T-testy. do, analiza przeżycia Kaplana-Meiera myszy C57BL/6J wystawionych na WBI i leczonych co tydzień nośnikiem lub PCC1, z nieleczonymi myszami jako kontrolą. CI, przedział ufności; HR, współczynnik ryzyka; DFI, okres wolny od choroby. P wartości obliczono za pomocą dwustronnych testów log-rank (Mantel-Cox). Dane na wykresach słupkowych przedstawiono jako średnią ± odchylenie standardowe i są reprezentatywne dla trzech niezależnych eksperymentów. NS, P > 0,05; *P <0,05; **P <0,01; ***P <0,001; ****P <0,0001. Następnie oceniliśmy wpływ leczenia przedklinicznego na parametry fizyczne myszy. Zgodnie z oczekiwaniami, WBI znacząco obniżyło wydolność wysiłkową i siłę mięśni mierzoną za pomocą bieżni i testów siły przyczepności w grupie pojazdów (ryc. 7i,j). Natomiast podawanie PCC1 przyniosło znaczne korzyści, przywracając te zdolności. Co ważniejsze, leczenie PCC1 zwiększyło przeżywalność (ryc. 7k). Nasze wyniki wskazują, że indukowana PCC1 eliminacja starzejących się komórek SA-β-Gal-dodatnich może być skuteczną strategią łagodzenia regresji fizycznej związanej ze starzeniem się i zmniejszenia śmiertelności w warunkach przedwczesnego starzenia się wywołanego stresorami środowiskowymi, takimi jak terapia cytotoksyczna. Następnie staraliśmy się zdefiniować wpływ starzejących się komórek na funkcje fizyczne u naturalnie starzejących się zwierząt. W tym celu leczyliśmy normalne 20-miesięczne myszy WT nośnikiem (etanol-glikol polietylenowy 400-Phosal 50 PG o 10:30:60) lub PCC1 (20 mg na kg przez wstrzyknięcie ip) (raz na 2 tygodnie) przez 4 miesiące (ryc. 8a). Ocena histologiczna wykazała znacząco podwyższony odsetek starzejących się komórek SA-β-Gal-dodatnich w nerkach, wątrobie, płucach i prostacie starszych zwierząt, który został odwrócony przez traktowanie PCC1 (Fig. 8b, c i rozszerzone dane Rys. 8a–f). Wyniki testów fizycznych wykazały, że PCC1 łagodził dysfunkcję fizyczną poprzez zwiększenie maksymalnej prędkości chodzenia, wytrzymałości na zwisanie, siły chwytu, wytrzymałości na bieżni, codziennej aktywności i sprawności równowagi wiązki zwierząt, którym podano PCC1 w porównaniu do tych, którym podawano pojazd (ryc. 8d-i), masa ciała i przyjmowanie pokarmu pozostały w dużej mierze niezmienione u myszy leczonych PCC1 (Dane rozszerzone Fig. 8g, godz). Warto zauważyć, że ekspresja SASP była znacznie zmniejszona w tkankach, takich jak płuca starszych myszy leczonych PCC1 w porównaniu z grupą, której podawano nośnik (Fig. 8j), wzorzec zgodny z mniejszym wydzielaniem czynników SASP przez ludzkie tkanki zrębowe leczone PCC1 (ryc. 5f). aSchematyczny projekt badania fizykalnego 20-miesięcznych samców myszy C57BL/6J leczonych PCC1 raz na 2 tygodnie (co dwa tygodnie) przez 4 miesiące. b, Reprezentatywne obrazy barwienia SA-β-Gal nerek młodych i starszych myszy traktowanych nośnikiem lub PCC1. Skala, 200 μm. C, Ocena ilościowa barwienia SA-β-Gal zgodnie z opisem w b. Dane reprezentują średnią ± sd D-h, Kwantyfikacja maksymalnej prędkości chodu (w stosunku do linii bazowej) (D), wytrzymałość wisząca (i), siła uścisku (F), wytrzymałość na bieżni (g) i codzienną aktywność (h) 20-miesięcznych samców myszy C57BL/6J po 4-miesięcznym leczeniu. i, Kwantyfikacja czasu potrzebnego na przecięcie belki wagi. Punkty danych przed i po leczeniu każdego zwierzęcia są połączone, aby umożliwić bezpośrednie porównanie efektów leczenia. J, Ilościowe profilowanie transkryptu ekspresji SASP w tkankach płuc pobranych od 6-miesięcznych nieleczonych (6M), 24-miesięcznych myszy leczonych nośnikiem (24M-nośnik) i 24-miesięcznych myszy leczonych PCC1 (24M-PCC1) . Dane są przedstawione jako średnia ± odchylenie standardowe i pochodzą z trzech powtórzeń biologicznych (n = 3 niezależne testy). do, Schematyczny projekt analizy długości życia myszy (obu płci) w wieku 24-27 miesięcy. L,m, Przeżycie po leczeniu (L) i przeżycie całego życia (m) krzywe zwierząt C57BL/6J leczonych co dwa tygodnie PCC1 (n = 91; 48 samców, 43 samice) lub pojazd (n = 80; 42 mężczyzn, 38 kobiet) począwszy od 24-27 miesiąca życia. n, Maksymalna prędkość chodzenia i wytrzymałość na zwisanie uśrednione w ciągu ostatnich 2 miesięcy życia (n = 10 myszy na grupę) i długość życia dla najdłużej żyjących myszy (top 20) w obu grupach. ten, Obciążenie chorobą i guzem w chwili śmierci. dla obu płci, n = 60 myszy na ramię. Dla mężczyzn, n = 31 dla PCC1 i n = 33 dla pojazdu. Dla kobiet, n = 29 dla PCC1 i n = 27 dla pojazdu. Do C-h,J, n = 3 biologicznie niezależne testy. Dane są wyświetlane jako wykresy pudełkowo-wąsowe, na których pudełko rozciąga się od 25. do 75. percentyla z medianą pokazaną jako linia pośrodku, a wąsy wskazują najmniejsze i największe wartości (D-h,n) lub jako średnia ± SD (ten). Niesparowany dwustronny T-testy (C-J,n,ten) i modele regresji proporcjonalnego ryzyka Coxa (L,m) wykorzystano do określenia istotności statystycznej. Aby ustalić potencjał eliminacji starzejących się komórek w celu przedłużenia pozostałej długości życia myszy WT, przeprowadziliśmy leczenie PCC1 rozpoczynając w bardzo podeszłym wieku (ryc. 8k). Myszy otrzymujące PCC1 (raz na 2 tygodnie lub co dwa tygodnie), począwszy od 24-27 miesiąca życia (mniej więcej w wieku 75-90 lat u ludzi) miały o 64,2% dłuższą medianę życia po leczeniu (lub o 9,4% dłuższą ogólną długość życia) i mniejsze zagrożenie zgonem (65,0%, P < 0,0001 niż w grupie leczonej podłożem (ryc. 8l,m). Dane te wskazują, że PCC1 może znacznie zmniejszyć ryzyko śmiertelności związanej z wiekiem u starych myszy. Następnie zapytaliśmy, czy zmniejszona śmiertelność u starszych zwierząt odbywa się kosztem zwiększonej zachorowalności w późnym okresie życia. Mierzyliśmy funkcje fizyczne myszy doświadczalnych leczonych PCC1 lub nośnikiem co miesiąc aż do śmierci. Pomimo dłuższego pozostałego okresu życia myszy traktowanych PCC1, sprawność fizyczna w ostatnich 2 miesiącach życia nie była znacząco niższa niż u myszy traktowanych nośnikiem (ryc. 8n). Po sekcji zwłok, częstość występowania kilku patologii związanych z wiekiem, obciążenie guzem i przyczyna śmierci nie różniła się istotnie między myszami leczonymi PCC1 i myszami leczonymi nośnikiem (ryc. 8o i rozszerzone dane Rys. 9a,b). Jednak ekspresja SASP była zmniejszona w narządach litych, co było w dużej mierze zgodne ze spadkiem poziomu krążącej interleukiny (IL)-6, czynnika stymulującego tworzenie kolonii (CSF)2 i białka chemoatraktantów monocytów (MCP)1, reprezentatywnych markerów SASP we krwi obwodowej (Dane rozszerzone Ryc. 9c – f). Zaobserwowaliśmy również zmniejszoną ekspresję SASP w CD3+ Limfocyty T we krwi obwodowej (Dane rozszerzone Ryc. 9g), linia komórkowa, która wykazuje silny wzrost p16INK4a ekspresja podczas starzenia się człowieka54. Ponadto leczenie PCC1 zmniejszyło stres oksydacyjny w tkankach wątroby, o czym świadczy zmniejszenie ilości adduktów produktu peroksydacji lipidów 4-hydroksynonenalu (HNE) oraz wzrost stosunku glutationu zredukowanego do utlenionego (Dane rozszerzone Ryc. 9h,i), zgodne z ogólnymi właściwościami flawonoidów, które wywierają działanie antyoksydacyjne poprzez przeciwdziałanie wolnym rodnikom i angażowanie systemu obrony antyoksydacyjnej55,56. Podsumowując, czynnik senolityczny PCC1, składnik fitochemiczny pochodzący z GSE (lub alternatywnie, w mniejszej ilości, z produktów naturalnych, takich jak ekstrakty z cynamonu, kakao, skórki jabłek i kory sosny), może zmniejszyć obciążenie starzejących się i prawdopodobnie innych komórek rozwija fenotyp prozapalny i jest z natury zależny od szlaków antyapoptotycznych związanych ze starzeniem się sprzyjającym przeżyciu i wydłuża czas życia po leczeniu bez powodowania zwiększonej zachorowalności u myszy. Niniejszym przedstawiamy dowód słuszności zasad, że nawet stosowany w późnym okresie życia, taka metoda terapeutyczna ma znaczący potencjał do znacznego opóźnienia dysfunkcji związanych z wiekiem, zmniejszenia chorób związanych z wiekiem i poprawy stanu zdrowia, zapewniając w ten sposób nową drogę do poprawy długość życia i zdrowia w przyszłej medycynie geriatrycznej. Starzenie się jest zasadniczo nieuniknionym procesem, który stopniowo powoduje pogorszenie czynności prawie wszystkich organizmów. Starzenie się komórek, stan trwałego zatrzymania wzrostu, stało się ostatnio zarówno znakiem rozpoznawczym, jak i motorem starzenia3,57. Starzejące się komórki z czasem gromadzą się w starzejących się tkankach i przyczyniają się do rosnącej listy patologii58. Usuwanie starzejących się komórek z progeroidalnych lub naturalnie starzejących się myszy przedłuża zdrowie, wydłuża żywotność i ogranicza zaburzenia związane z wiekiem, w tym między innymi miażdżycę, chorobę zwyrodnieniową stawów i choroby neurodegeneracyjne59,60,61,62. Ostatnie postępy w badaniach związanych z wiekiem skłoniły do poszukiwania leków, które mogą selektywnie celować w starzejące się komórki, w szczególności nowej klasy środków geroprotekcyjnych zwanych senolitykami lub, mniej agresywnie, senomorfikami. Do tej pory zgłoszono garstkę senolityków, w tym dasatynib i kwercetynę, fizetynę, piperlonguminę, inhibitory białka szoku cieplnego (HSP)90 i inhibitory rodziny BCL-2, takie jak ABT-263 (navitoklaks) i ABT-737 (odnośniki 11,12,13,18,19,21,22). Wśród nich inhibitory BCL-2 są najszerzej stosowanymi lekami senolitycznymi, chociaż pierwotnie opracowano je jako terapie chłoniaka. ABT-737 celuje w BCL-2, BCL-xL i BCL-w, ale z niską rozpuszczalnością i biodostępnością po podaniu doustnym. Bardziej skuteczny do stosowania in vivo, ABT-263 hamuje głównie BCL-2 i BCL-xL, podczas gdy często powoduje małopłytkowość. Biorąc pod uwagę wyraźne skutki uboczne niektórych związków senolitycznych, istnieje potrzeba zidentyfikowania nowych związków o aktywności senolitycznej, ale zmniejszonej cytotoksyczności. W tym badaniu przeprowadziliśmy badanie przesiewowe biblioteki leków opartej na PDMA, składającej się głównie z produktów naturalnych, w celu zidentyfikowania nowego środka (środków), który może szeroko atakować starzejące się komórki z optymalną skutecznością i bezpieczeństwem in vivo. W rezultacie zidentyfikowaliśmy PCC1, środek fitochemiczny pochodzący ze źródeł naturalnych, jako związek senolityczny o szerokim spektrum działania. Jako szczególna zaleta PCC1 może alternatywnie działać jako środek senomorficzny, aby zminimalizować ekspresję SASP, gdy jest stosowany w niskich stężeniach. Taka korzystna cecha PCC1 rzeczywiście w dużej mierze przypomina GSE, która może generować zarówno efekty senomorficzne, jak i senolityczne. Strategie genetyczne i farmakologiczne wykazały szereg korzyści z eliminacji starzejących się komórek w celu opóźnienia starzenia i kontrolowania chorób. Starzenie się komórek może być wyzwalane przez różne bodźce, od aktywacji onkogennej, stresu genotoksycznego, po reakcję zapalną i wyczerpanie replikacyjne. Kilka związków zidentyfikowano jako senolityki o szerokim spektrum działania, podczas gdy inne działają selektywnie tylko na pewien typ starzejącej się komórki. Różnice w swoistości implikują indywidualne wybory senolityków, które zależą głównie od ich zamierzonego zastosowania klinicznego. Niedawne badania wykazały, że ouabaina, naturalny związek należący do rodziny glikozydów nasercowych, jest środkiem senolitycznym, który może być stosowany zarówno do eliminacji starzejących się komórek, jak i terapii przeciwnowotworowej, przy czym ta ostatnia jest realizowana poprzez podwójny mechanizm działania63. W tej pracy odkryliśmy PCC1 jako kolejny nowy, naturalny i silny senolityk, który selektywnie i specyficznie indukuje apoptozę starzejących się komórek, ale z ograniczoną cytotoksycznością wobec proliferujących komórek64. Warto zauważyć, że w niższych stężeniach PCC1 hamuje ekspresję SASP, właściwość wspólną dla niektórych flawonoidów pochodzenia roślinnego, takich jak apigenina i kaempferol, które mogą działać jako senomorfiki ograniczające wpływ starzejących się komórek na stany związane z wiekiem65,66. Chociaż niewiele badań ujawniło taki podwójny mechanizm działania środków naturalnych na starzejące się komórki, niedawno zsyntetyzowany Fe funkcjonalizował powierzchnię kwercetyny3TEN4 nanocząsteczki wykazywały zarówno potencjał senolityczny, jak i senomorficzny w ludzkich fibroblastach poprzez zwiększenie aktywności kinazy białkowej aktywowanej przez AMP (AMPK)67. Mechanizm, dzięki któremu PCC1 osiąga efekty senolityczne, wydaje się złożony i wymaga dalszych badań. Nasze dane sugerują, że PCC1 zaburza funkcjonalną integralność mitochondriów, naruszając Δψm, prowadząc do zwiększonej produkcji wolnych rodników, takich jak ROS i powodując uwalnianie cytochromu c w starzejących się komórkach, ale nie w komórkach proliferujących. Możliwym powodem tej specyficzności jest to, że starzejące się komórki mają tendencję do tworzenia zdepolaryzowanej błony komórkowej i mają zwiększone stężenia H+ (ref. 64), cecha, która może uczynić je bardziej podatnymi na działanie PCC1. Warto zauważyć, że tym zmianom towarzyszy zwiększona ekspresja czynników proapoptotycznych, w szczególności NOXA i PUMA, zdarzeń, które również w sposób krytyczny promują apoptozę starzejących się komórek. W rodzinie procyjanidyn, których członkowie są znani z tego, że pochodzą z polimeryzacji cząsteczek flawan-3-olu i występują jako oligomery lub polimery28PCC1 wydaje się funkcjonalnie unikalny. Nasze dane eksperymentalne wskazują na zauważalną różnicę między PCC1 (trimerem) a innymi procyjanidynami (z których większość to rzeczywiście monomery lub dimery, takie jak PCB2). Ponieważ nie zbadaliśmy kompleksowo członków rodziny procyjanidyn, to czy liczba monomerów w cząsteczce determinuje jej potencjał przeciwstarzeniowy, pozostaje otwartym, ale intrygującym pytaniem, a mechanizmy leżące u ich podstaw zasługują na dalsze badania w przyszłości. Starzenie się komórek samo w sobie jest wysoce niejednorodnym procesem, który zależy od różnego pochodzenia komórek i bodźców środowiskowych68. Jedną z kluczowych cech PCC1 jest jego zdolność do skutecznego usuwania starzejących się komórek w szerokim spektrum typów komórek i stresorów, w tym replikacji, onkogenów, napromieniania i chemioterapii. W tym badaniu porównaliśmy PCC1 z innymi zgłoszonymi senolitykami pod kątem wpływu na ludzkie komórki zrębowe, fibroblasty, komórki HUVEC i MSC, główne typy komórek w mikrośrodowisku tkankowym. Jak doniesiono, ABT-263 eliminuje starzejące się ludzkie fibroblasty embrionalne (HEF) i HUVEC, ale ma niewielki wpływ na ludzkie preadipocyty12,18. Połączone stosowanie dazatynibu i kwercetyny może zubożyć wszystkie trzy typy starzejących się komórek w sposób zależny od dawki, ale jest toksyczne dla komórek proliferujących11,69,70. Fisetyna, inny naturalny flawonoid zgłaszany jako środek senolityczny, wykazuje niewielki wpływ na starzejące się HEF i preadipocyty tylko w wysokich stężeniach20,21. Z kolei PCC1 może przezwyciężyć te ograniczenia, w tym zależność od typu komórki, wysoką toksyczność w niestarzejących się komórkach i niską skuteczność wobec starzejących się komórek. Chociaż, gdy jest stosowana samodzielnie, kwercetyna (inny flawonoid w GSE) per se wykazywała cytotoksyczność wobec starzejących się komórek zrębu, jej skuteczność jest ogólnie niższa niż w przypadku PCC1 (porównaj ryc. 2a,c i Rysunki uzupełniające. 3n oraz 4n). Razem PCC1 ma lepszą aktywność senolityczną z wysoką swoistością i wydajnością dla szerszego zakresu typów komórek niż wiele zgłoszonych senolityków, takich jak ABT-263, dasatynib, kwercetyna i fisetyna, i może celować w starzejące się komórki generowane przez kilka głównych typów induktorów starzenia. Odkryliśmy, że PCC1 wywiera działanie indukujące apoptozę na starzejące się komórki w warunkach in vivo. PCC1 skutecznie wyeliminował komórki starzejące się indukowane terapią i zmniejszył markery starzenia w narządach litych, podkreślając jego skuteczność in vivo. W tym badaniu leczyliśmy również naturalnie starzejące się myszy PCC1 i testowaliśmy jego wpływ na starzejące się komórki, przewlekłe zapalenie i sprawność fizyczną. Po pierwsze, leczenie PCC1 zmniejszyło starzejące się komórki w wielu tkankach i zmniejszyło sygnatury związane z SASP, jak wykazała analiza GSEA. Po drugie, PCC1 może tłumić ekspresję genów związanych z SASP w starzejącej się wątrobie i nerkach oraz zmniejszać przewlekłe stany zapalne niskiego stopnia we krwi. Po trzecie, PCC1 łagodził upośledzoną funkcję motoryczną, równowagę, wyczerpany wysiłek fizyczny, siłę mięśni i spontaniczną eksplorację u starszych myszy. Najważniejsze, wydajność na RotaRod i testach równowagi wiązki w grupie leczonej PCC1 była lepsza w porównaniu z wynikami w początkowych warunkach obróbki wstępnej. Podsumowując, związek fitochemiczny PCC1 selektywnie atakuje starzejące się komórki w mikrośrodowisku tkankowym i generuje niezwykłe efekty biologiczne u naturalnie starzejących się myszy. Podobnie jak chemicznie syntetyzowane odpowiedniki, procyjanidyny pochodzenia naturalnego wykazują działanie przeciwzapalne, przeciwartretyczne, przeciwalergiczne i przeciwnowotworowe, wymiatają wolne rodniki tlenowe i tłumią wywołaną promieniowaniem aktywność peroksydacji36,71. Wykazano, że PCC1 jako trimer epikatechiny wyizolowany z materiału roślinnego, przede wszystkim z pestek winogron, zapewnia korzyści zdrowotne w przewlekłych stanach patologicznych72. Jednak dokładna ocena skutków toksykologicznych PCC1 in vivo ma kluczowe znaczenie dla potencjalnego zastosowania klinicznego. Nasze dane wykazały, że leczenie wysokim stężeniem (20 mg na kg) i wysoką częstotliwością PCC1 (co dwa tygodnie) nie miało widocznych działań toksycznych ogólnoustrojowych. Podsumowując, nasze badanie pokazuje wyższość i względne bezpieczeństwo strategii geroochronnej, która selektywnie celuje w starzejące się komórki w tkankach starzejących się lub uszkodzonych przez leczenie w szerokim spektrum typów komórek. Możliwe jest jednak, że stężenia PCC1 in vivo różnią się w zależności od narządu i zależą od podanej dawki, farmakodynamiki i farmakokinetyki, a lokalne stężenia nie są wystarczająco wysokie, aby osiągnąć efekt senolityczny w niektórych typach tkanek. W tym przypadku, Podsumowując, nasze badanie otwiera nową drogę do przedłużania zdrowia i przedłużania życia oraz leczenia patologii związanych z wiekiem za pomocą środka senoterapeutycznego (o potencjale senomorficznym i senolitycznym), który pochodzi z naturalnych źródeł i ma wyraźną skuteczność. Potencjalne działanie przeciwstarzeniowe PCC1 wykazane w naszych testach przedklinicznych stanowi dobre wsparcie dla dalszego translacyjnego i klinicznego rozwoju PCC1, z ogólnym celem osiągnięcia dłuższego i zdrowszego życia.Główny
Wyniki
Niskie stężenia GSE ograniczają ekspresję SASP
GSE ma aktywność senolityczną w wysokich stężeniach
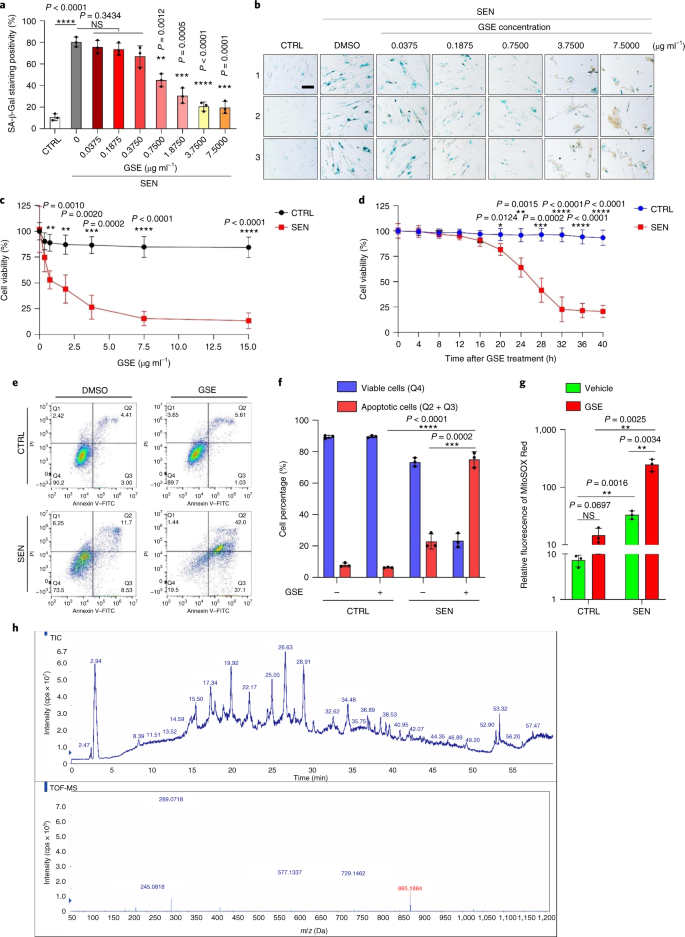
Składnik PCC1 GSE ma działanie senolityczne
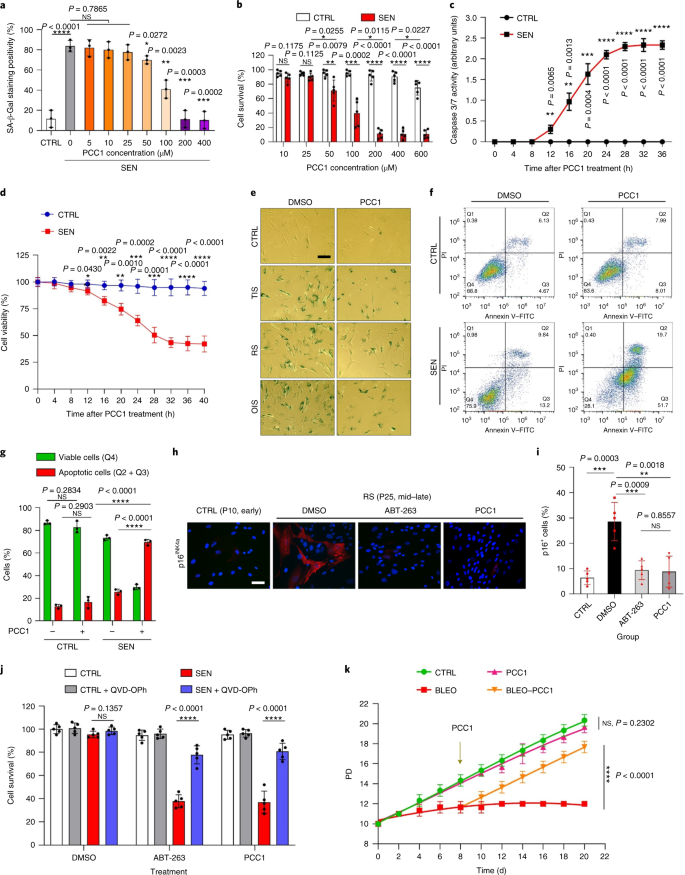
PCC1 indukuje dysfunkcję mitochondriów w starzejących się komórkach
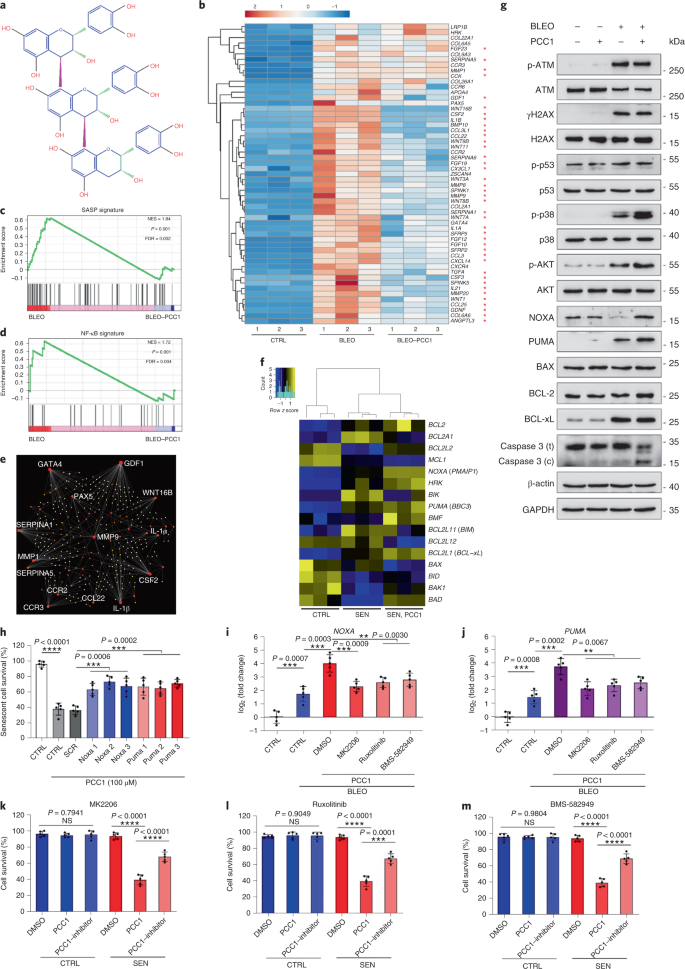
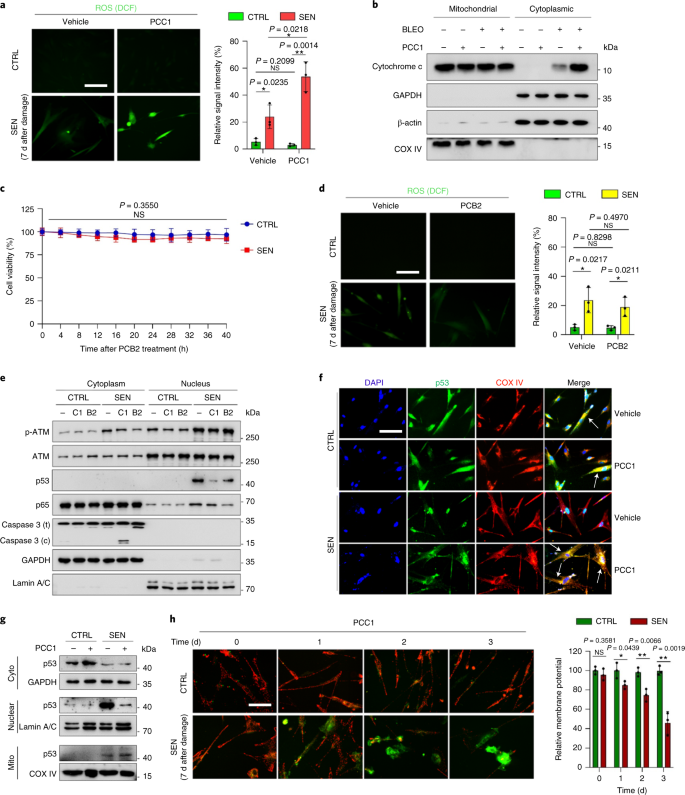
PCC1 promuje regresję guza i zmniejsza chemiooporność

Usuwanie starzejących się komórek w wyniku leczenia PCC1 łagodzi dysfunkcje fizyczne
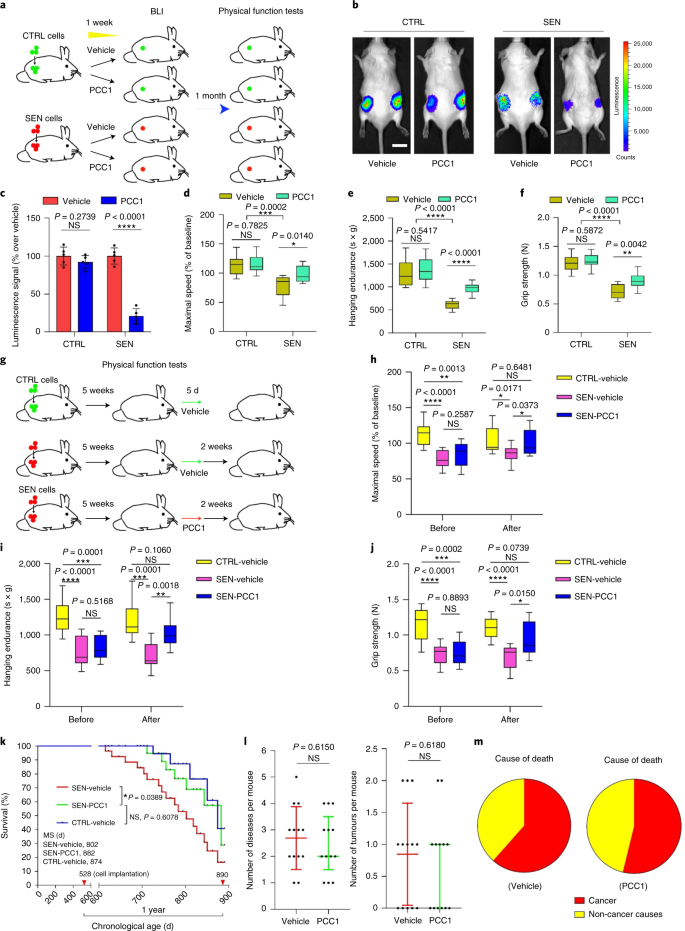
PCC1 podtrzymuje sprawność fizyczną i przedłuża przeżycie starszych myszy
Dyskusja




